Ginecologia
- Home
- Ginecologia
A endometriose é uma doença que atinge mulheres em idade reprodutiva e que consiste na presença de endométrio (camada interna do útero), fora do útero. Esse revestimento por razões não totalmente esclarecidas, pode implantar-se em outros órgãos: ovários, trompas, intestinos, superfície externa e parede do útero, bexiga, peritôneo (membrana que reveste internamente os órgão pélvicos e abdominais), vagina e colo do útero. Mais raramente, pode ser encontrada ainda no fígado, cicatrizes antigas (como as de cesárea), diafragma (músculo que separa internamente a cavidade torácica da cavidade pélvica), pulmões e até cérebro.
Os focos de endométrio em locais não habituais são estimulados mês a mês devido à ação hormonal decorrente do ciclo menstrual normal e causam uma inflamação local que ocasiona dor. Inicialmente a dor é mais no período menstrual, mas progressivamente pode aumentar a frequência e por uma reação do próprio organismo contra este processo, formam-se aderências ao redor deste local, levando a sintomas mais graves como dor contínua e infertilidade.
Seus principais sintomas – e que geralmente levam a paciente a procurar um médico – são dor e dificuldade de engravidar. Em função disso, a manifestação da endometriose segue a “regra dos três Ds”: dismenorréia (menstruação difícil e dolorosa), dispaurenia (dor durante a relação sexual) e dificuldade para engravidar (e abortamentos de repetição).
A etiologia da endometriose é incerta, mas existem algumas teorias que tentam explicar. A mais difundida é a teoria da menstruação retrógrada (proposta por Sampson em 1921). Tal teoria sugere a presença de fluxo menstrual retrógrado através das tubas uterinas e o implante e adesão destes fragmentos de endométrio no peritônio. Entretanto, a menstruação retrógrada pode ser observada em até 90% das mulheres, mas nem todas desenvolvem a doença. Uma teoria pra isso é que somente irão desenvolver a doença algumas mulheres que tenham uma alteração imunológica. Weed e Arguembourg (1980) foram os primeiros a sugerir um distúrbio imunológico para explicar a ocorrência da endometriose. A partir de então, muitos estudos têm relacionado a doença a alterações específicas da imunidade, o que diminuiria as chances do organismo em defender-se de células do endométrio, que se implantariam nos tecidos e desenvolveriam a doença.
Outra teoria, descrita no final do século XIX, propunha que a endometriose se originaria de remanescentes dos ductos de Wolff ou remanescentes dos ductos de Müller (ductos embrionários que originam o trato reprodutor masculino e feminino), que sofreriam processo de metaplasia transformando-se em tecido endometrial. Metaplasia é a transformação de um tecido em outro. Nesta linha tem também a teoria da chamada metaplasia celômica que considera que células do epitélio celômico (presentes no peritônio e nos ovários) podem ser induzidas a se diferenciar em endometriose. Assim, essas células sob indução hormonal ou traumática sofreriam modificações estruturais, funcionais e proliferariam sob o peritônio com um aspecto endometrióide.
Essas teorias explicam bem os focos de endometriose no peritônio, mas não os focos de endometriose à distância, como no pulmão ou cérebro. Para explicar isso, uma outra teoria defende que células endometriais podem cair na circulação sanguínea e linfática, e então implantar-se à distância.
A real causa da endometriose,portanto, não é sabida. Muitos acreditam que seja uma combinação destas teorias ou ainda que cada tipo de endometriose tenha uma etiologia diferente. Lembramos que existe também a influência de um componente genético. Apesar de ainda não bem definido, nota-se uma predisposição familiar ao desenvolvimento da doença e muitos estudos vem sendo desenvolvidos para encontrar possíveis genes envolvidos no aparecimento da endometriose.
Referências Bibliográficas
A endometriose atinge mulheres em idade reprodutiva (19 a 44 anos). A exata prevalência não é sabida pois há muitos casos assintomáticos, onde não se faz o diagnóstico. Estima-se que atinge de 7 a 14% das mulheres, cerca de 25 a 50% das mulheres inférteis e até 80% das mulheres com dor pélvica crônica.
O real perfil da paciente portadora de endometriose é impreciso. Sabe-se que acomete mulheres em idade reprodutiva, com maior frequência de diagnóstico entre 25 e 34 anos, não parecendo haver diferença de prevalência entre as raças.
Entre os fatores que podem estar relacionados com uma maior frequência da doença estão:
– Infertilidade
– Idade precoce da primeira menstruação
– Ciclos menstruais curtos
– Hipermenorréia (aumento dos dias de sangramento menstrual)
– Nuliparidade (não ter filhos)
– Má formação do trato genital
– Baixo Peso ao Nascer
– Parente de primeiro grau com endometriose
– Pacientes mais altas e magras
– Álcool e cafeína
– Dieta rica em gordura trans e carne vermelha
Entre os fatores protetores:
– Múltiplas gestações / partos
– Lactação prolongada
– Maior índice de massa corpórea
– Exercícios
– Dieta rica em vegetais, frutas e ômega 3
Referências Bibliográficas
Balasch J, Creus M, Fabregues F, Carmona F, Ordi J, Martinez-Roman S, Vanrell JA. Visible and nonvisible endometriosis at laparoscopy in fertile and infertile women and in patients with chronic pelvic pain: a prospective study. Hum Reprod. 1996;11(2):387-91.
Barbieri RL. Etiology and epidemiology of endometriosis. Am J Obstet Gynecol. 1990;162:565-7.3 – West CP. Endometriosis. Br Med J. 1990;301:189-90.
Buck Louis GM, Hediger ML, Pena JB. Intrauterine exposures and risk of endome- triosis. Hum Reprod. 2007;22:3232–3236.
Dhillon PK, Holt VL. Recreational phy- sical activity and endometrioma risk. Am J Epidemiol. 2003;158:156–164.
Eskenazi B, Warner ML. Epidemiology of endometriosis.Obstet Gynecol Clin orth Am. 1997;24:235- 58.
Ferrero S, Anserini P, Remorgida V, et al. Body mass index in endometriosis. Eur J Obstet Gynecol Reprod Biol. 2005; 121:94–98.
Hansen KA, Chalpe A, Eyster KM. Management of endometriosis-associated pain. Clin Obstet Gynecol. 2010 Jun;53(2):439-48.
Hediger ML, Hartnett HJ, Louis GM. Association of endometriosis with body size and figure. Fertil Steril. 2005;84: 1366–1374.
Houston DE, Noller KL, Melton LJ, Selwyn BJ. The epidemiology of pelvic endometriosis. Clin Obstet Gynecol. 1988;31:787-800.
Matalliotakis IM, Arici A, Cakmak H, et al. Familial aggregation of endometriosis in the Yale Series. Arch Gynecol Obstet. 2008;278:507–511.
Matorras R, Rodíquez F, Pijuan JI, Ramón O, Gutierrez de Terán G, Rodriguez-Escudero F. Epidemiology of endometriosis in infertile women. Fertil Steril. 1995;63:34-8.
MissmerSA,CramerDW.Theepidemio- logy of endometriosis. Obstet Gynecol Clin North Am. 2003;30:1–19.
Missmer SA, Hankinson SE, Spiegelman D, et al. In utero exposures and the in- cidence of endometriosis. FertilSteril. 2004;82:1501–1508.
Missmer SA, Hankinson SE, Spiegelman D, et al. Reproductive history and endometriosis among premenopausal women. Obstet Gynecol. 2004;104(5 Pt 1): 965–974.
Nawroth F, Rahimi G, Nawroth C, et al. Is there an association between septate uterus and endometriosis? Hum Reprod. 2006;21:542–544.
Parazzini F, Chiaffarino F, Surace M, et al. Selected food intake and risk of endome- triosis. Hum Reprod. 2004;19:1755–1759
Vigano P, Parazzini F, Somigliana E, et al. Endometriosis: epidemiology and aetiological factors. Best Pract Res Clin Obstet Gynaecol. 2004;18:177–200.
Existem várias teorias que relacionam a alimentação com evolução e sintomatologia da endometriose. Os aspectos nutricionais estão principalmente envolvidos na concentração de estrógeno no sangue, alívio da dor e intensidade do processo inflamatório. Entre algumas mudanças nutricionais que podem ser benéficas para pacientes com endometriose, estão:
– Aumento na ingestão de líquidos e fibras.
As fibras ajudam na manutenção de um hábito intestinal adequado, o que pode reduzir as dores abdominais. Além disso, ajudam na excreção de estrógeno pelas fezes, diminuindo os níveis circulantes. A preferência deve ser dada a fibras solúveis (aveia e farelo de trigo). Outras fontes de fibras (porém insolúveis) são frutas com casca ou bagaço, vegetais folhosos e milho.
– Substituir a ingestão de gorduras saturadas e monossaturadas por gorduras poli-insaturadas (ricas em ômega 3).
Gordura saturada está presente na carne vermelha e no leite e seus derivados. O ômega 3 está presente em peixes, frutos do mar, amêndoas, nozes e óleos vegetais (como canola, algodão, linhaça e oliva). Deve-se dar preferência para estes óleos no preparo dos alimentos ao invés de manteiga.
O efeito na endometriose está no fato de que gorduras saturadas são ricas em ácido linoléico, que é convertido em ômega 6 e então em ácido araquidônico. Este está envolvido na produção de prostaglandinas, que são mediadores que aumentam o processo inflamatório, podendo agravar a endometriose. Por outro lado, o ômega 3 (ácido linolênico) é convertido em EPA (ácido graxo eicosapentaenóico), que diminui a reação inflamatória.
– Aumentar a ingesta de alimentos ricos em antioxidantes, como as vitaminas A, C, E, do complexo B e Zinco.
O processo inflamatório da endometriose leva à produção de radicais livres, que desencadeiam uma série de respostas imunes e inflamatórias que levam a maior dano celular. Os antioxidantes podem ter um efeito protetor neste sentido. Entre os antioxidantes estão:
– vitamina A: tem ação no sistema imune e na diminuição do stress oxidativo. Seu principal precursor é o betacaroteno, presente em vegetais verde-escuros, amarelos e alaranjados (cenoura e abóbora) e frutas dessa cor (melão, mamão, manga).
– vitamina C: tem ação anti-histamínica (presente no processo inflamatório) e antioxidante. Seu precursor, o ácido ascórbico, está presente nas frutas cítricas.
– vitamina E: além de efeito antioxidante, tem efeito analgésico. Encontrada em sementes de abóbora, vegetais verde-escuros, abacate, salmão e ovos.
– vitaminas do complexo B (B1, B6 e B12): Apresentam enfeito analgésico e anti-inflamatório. Presentes em peixes como salmão, ervilhas, feijão, semente de girassol, grão de bico e alimentos integrais.
– Zinco: Protege as células contra radicais livres, é importante na absorção do betacaroteno e tem efeito anti-inflamatório, inibindo a liberação de histamina e outros mediadores. Presente nos peixes,fígado, frutos do mar e ovos.
–Reduzir o consumo de carne vermelha e aves, especialmente aquelas não orgânicas ou de procedência desconhecida pois podem ter altas concentrações de substâncias hormonais ativas (como xenestrogênios), que podem agravar a endometriose.
Xenoestrogênios são compostos químicos que em contato com o organismo podem mimetizar ações dos hormônios (no caso, estrógeno), por ter afinidade por esses receptores. A gordura animal é um grande retentor de xenoestrogênios, assim como pode reter drogas veterinárias e hormônios e portanto deve-se ter cuidado com a procedência dos produtos de origem animal. Entre as substâncias mais conhecidas estão: dioxina, bisfenol e hexaclorobenzeno. Plásticos, agrotóxicos, solventes, agentes de branqueamento, refrigerações, produtos de limpeza e muitos outros possuem em sua composição substâncias xenoestrogênicas. Quando está no organismo o xenoestrogênio dificilmente é excretado e se acumula nos tecidos gordurosos, no cérebro, no aparelho reprodutor e em vários outros órgãos.
– diminuir e em alguns casos evitar o consumo de leite e seus derivados quando estes não forem orgânicos, devido às altas doses de hormônios presentes na gordura animal.
– evitar o consumo de alimentos industrializados, embutidos ou ultraprocessados, como frios, linguiça, salsicha, hambúrguer, biscoitos, pães e doces refinados, molhos e temperos prontos e preparações enlatadas.
Muitos utilizam na sua produção gordura hidrogenada, que pode ter altas concentrações de xenoestrogênios, presentes também em produtos usados no processo de refinamento e conservação de tais alimentos. Embalagens plásticas podem conter bisfenol A, um importante xenostreogênio que pode ser absorvido pelos alimentos.
Assim, algumas orientações nutricionais podem ser benéficas em pacientes com endometriose, tanto para minimizar a dor, como auxiliar no combate a progressão da doença. O papel exato e impacto da dieta na endometriose ainda necessita mais estudos, mas melhorar alguns hábitos nutricionais podem melhorar a qualidade de vida da paciente.
Referências Bibliográficas
O quadro clínico da endometriose é diversificado, sendo que cerca de 16% das pacientes são assintomáticas. As principais manifestações clínicas da doença são a dor pélvica (prinicpalmente durante o período menstrual), dispareunia (dor durante a relação sexual) e dificuldade em engravidar. Na presença destas condições é recomendável a investigação de endometriose. Embora estas manifestações sejam muito sugestivas dessa doença, nem sempre estão presentes ,não são exclusivas dessa patologia e requerem o diagnóstico diferencial com outras condições, como aderências, processos infecciosos, neoplasias, patologias intestinais ou urinárias, entre outras.
Dependendo do acometimento de outros órgãos, as pacientes podem apresentar durante o período menstrual ,sintomas urinários, intestinais e torácicos.
Referências Bibliográficas
O quadro clínico pode muitas vezes sugerir a endometriose, mas como os sintomas são inespecíficos e podem sobrepor-se a outras patologias, para um diagnóstico definitivo necessita-se melhor investigação.
Dosagem sanguínea de CA-125 ou outros marcadores podem contribuir com o diagnóstico, mas são muito inespecíficos. Exames de imagem como ultrassom transvaginal com preparo intestinal e ressonância nuclear magnética da pelve podem ajudar no diagnóstico de endometriose ovariana e infiltrativa, mas em casos mais leves não tem uma boa acurácia.
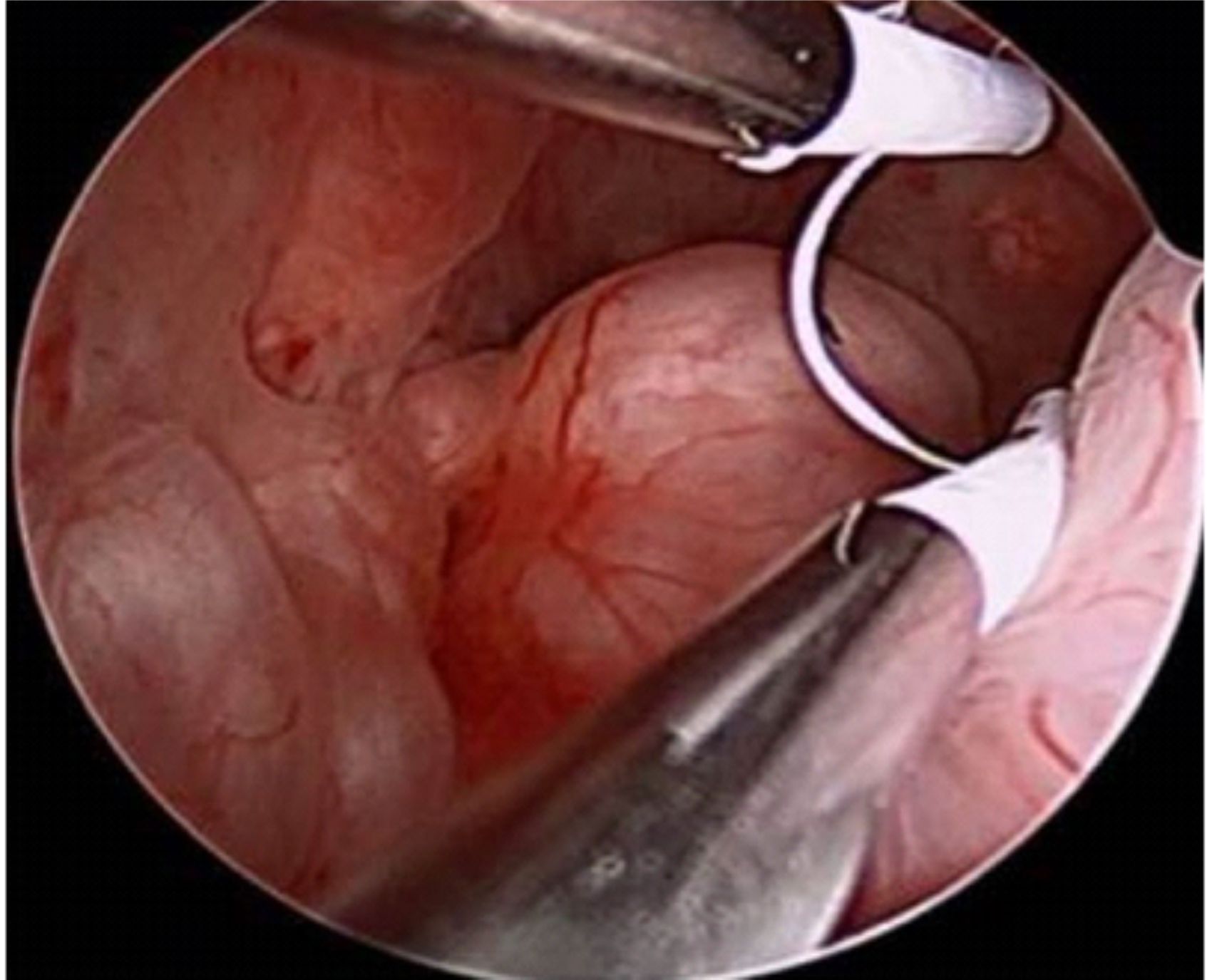
Segundo consenso da European Society of Human Reproduction and Embryology (ESHRE) e da American Society for Reproductive Medicine (ASRM), o padrão-ouro para diagnóstico de endometriose é a videolaparoscopia com inspeção direta da cavidade e visualização dos implantes, podendo ainda realizar-se biópsias para confirmação histopatológica.
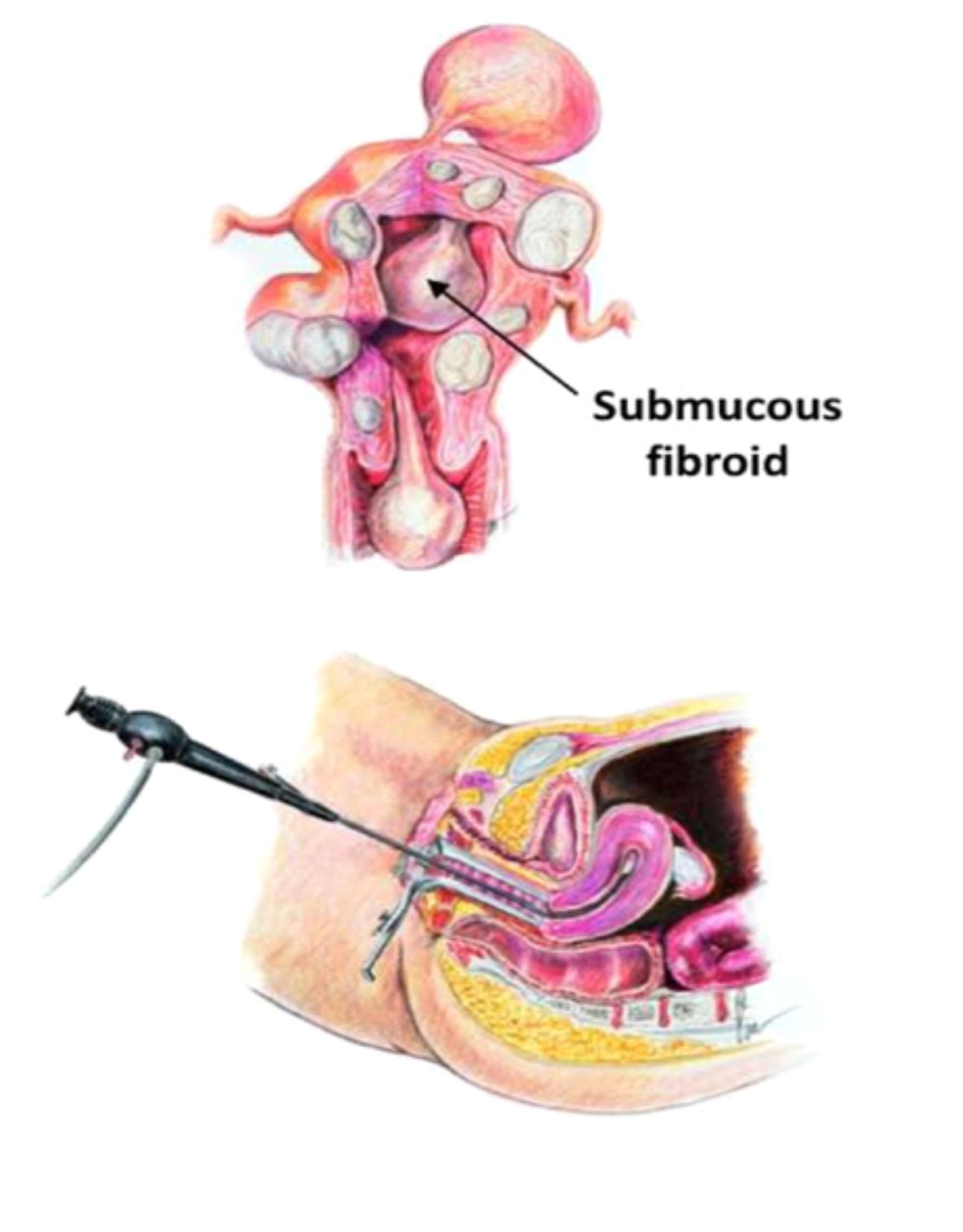
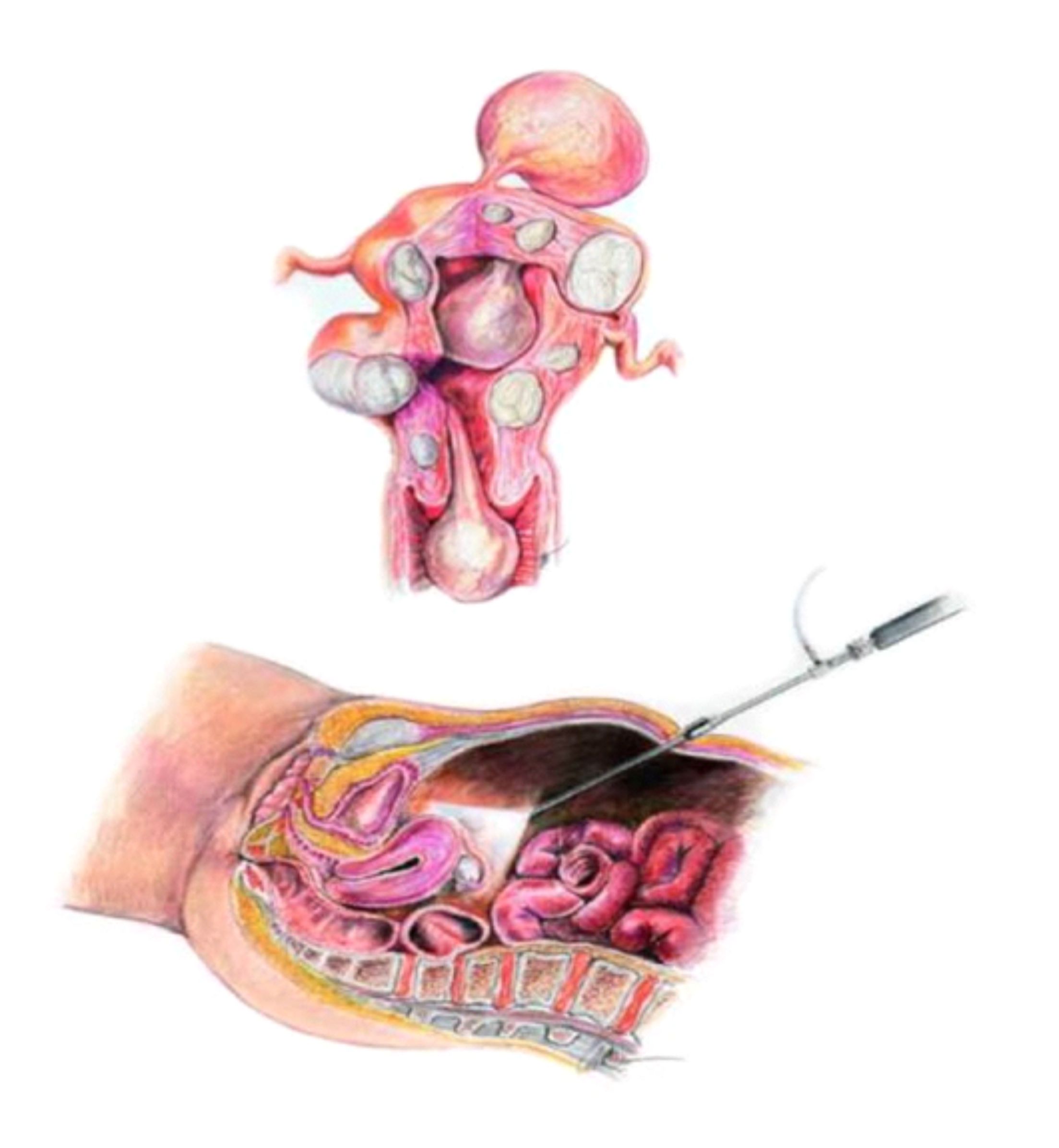
A videoaparoscopia é um procedimento cirúrgico, feito em ambiente hospitalar sob anestesia geral. Uma microcâmera de vídeo é introduzida no abdomen por meio de uma incisão mínima na região do umbigo e assim temos uma visualização completa dos órgão pélvicos: útero, trompas, ovários, reto e bexiga, além de uma visão do abdome superior. Essa técnica permite então, o diagnóstico da endometriose, estadiar a extensão da doença e tratar simultaneamente as lesões. Como é um procedimento invasivo, em casos selecionados, pode-se tentar um tratamento empírico sem a realização da videolaparoscopia.
Referências Bibliográficas
Abrao MS, Goncalves MO, Dias JA Jr, Podgaec S, Chamie LP, Blasbalg R.Comparison betweenclinical examination, transvaginal sonography and magnetic resonance imaging for the diagnosis of deep endometriosis.Hum Reprod. 2007;22:3092-3097.
Bazot M, Darai E, Hourani R, Thomassin I, Cortez A, Uzan S, Buy JN. Deep pelvic endometriosis: MR imaging for diagnosis and prediction of extension of disease. Radiology. 2004;232:379-389.
Chapron C, Dubuisson JB, Pansini V, Vieira M, Fauconnier A, Dousset B. Routine clinical examination is not sufficient for the diagnosis and establishing the location of deeply infiltrating endometriosis. J Am Assoc Gynecol Laparosc. 2002;9:115-119.
Koninckx PR, Meuleman C, Oosterlynck D & Cornillie FJ. Diagnosis of deep endometriosis by clinical examination during menstruation and plasma CA-125 concentrations. Fertil Steril. 1996;65:280-287.
Revised American Society for Reproductive Medicine classification of endometriosis: 1996. Fertil Steril. 1997;67(5):817-21.
The ESHRE Guideline for the Diagnosis and Treatment of Endometriosis. http://guidelines endometriosis org/ 2008. [disponivel em 25 de fev de 2010]
Visando uma melhor definição do tratamento, prognóstico e seguimento da endometriose, ao longo dos anos foram sendo propostas diferentes classificações da doença de acordo com a localização das lesões, o grau de comprometimento dos órgãos e sua severidade. Por muito tempo a classificação mais aceita foi a da American Fertility Society que divide a doença em mínima, leve, moderada e severa, sendo inclusive ainda adotada por muitas clínicas. Entretanto, estudos recentes tem recomendado uma nova classificação com melhor associação entre clínica e estadiamento e relação com a fisiopatogenia. Essa nova classificação divide a endometriose em 3 tipos distintos: endometriose superficial, endometriose ovariana e endometriose profunda.
Apesar dos três tipos serem endometriose, são consideradas doenças diferentes, não possuem a mesma origem e portanto, recebem tratamentos diferenciados. Esta divisão tem facilitado o tratamento e a cura, e mostra a importância do médico especialista em conhecer cada um dos detalhes que envolvem a doença.
Além desses tipos, a endometriose em casos mais raros pode estar localizada fora da cavidade abdominal, como nos pulmões, tórax e até mesmo no cérebro.
Referências Bibliográficas
A endometriose peritoneal, ou superficial, apresenta como característica focos de tecido endometriótico sobre o peritônio superficial, com menos de 5 mm de profundidade. Esses focos podem possuir diversas características dependendo do momento de evolução da doença. Inicialmente, apresentam-se como áreas avermelhadas ou vesículas. Com o passar do tempo, tornam-se escuras (marrom-preto,) e após, esbranquiçadas, com sinais de fibrose e desvascularização.
O quadro clínico é variável e sua intensidade não tem relação com a extensão das lesões. Exames de imagem geralmente ajudam pouco. O diagnóstico geralmente só é feito com a videolaparoscopia. A cirurgia é útil no diagnóstico e tratamento da doença que consiste na remoção de todos os focos.
Quando há forte suspeita pela clínica, pode-se tentar uma terapia clínica com medicamentos que bloqueiam a menstruação, desde que não existam outras indicações para a cirurgia. Essa conduta é geralmente adotada para adolescentes uma vez que a dismenorréia é muito frequente nesta faixa etária, mesmo sem endometriose. No entanto, quando a terapia hormonal combinada (como pílulas anticoncepcionais orais) ou antiinflamatórios falham, a videolaparoscopia deve ser indicada, uma vez que cerca de 35 a 73% destas mulheres têm endometriose no momento da cirurgia.
Em relação a pacientes inférteis com endometriose superficial, os estudos não são conclusivos se realmente a retirada de lesões melhora o prognóstico reprodutivo, entretanto os guidelines da ASRM, ESHRE (European Society of Human Reproduction and Embryology) e RCOG (Royal College of Obstetricians and Gynaecologists) orientam que as pacientes inférteis com endometriose peritoneal beneficiam-se do tratamento cirúrgico por videolaparoscopia com retirada das lesões.
Referências Bibliográficas
Fuchs F, Raynal P, Salama S, Guillot E, Le Tohic A, Chis C, Panel P. Fertilité après chirurgie cœlioscopique de l’endométriose pelvienne chez des patientes en échec de grossesse. Journal de Gynécologie Obstétrique et Biologie de la Reproduction. 2007;36:354-359.
Gambone JC, Mittman SB, Munro MG, Scialli AR. Winkel, CA and the Chronic Pelvic Pain/ Endometriosis Working Group Consensus statement for the management of chronic pelvic pain and endometriosis: proceedings of an expert-panel consensus Process. Fertil Steril. 2002;78:961-72.
Kennedy S, Bergqvist A, Chapron C, D’Hooghe T, Dunselman G, Greb R, Hummelshoj L, PrenticeA, Saridogan E, ESHRE Special Interest Group for Endometriosis Endometrium Guideline Development Group. ESHRE Special Interest Group for Endometriosis and Endometrium Guideline Development Group. ESHRE guideline for the diagnosis and treatment of endometriosis. Hum Reprod. 2005; 20:2698- 2704.
Royal College of Obstetricians and Gynaecologists (RCOG). The investigation and management of endometriosis. London (UK): Royal College of Obstetricians and Gynaecologists (RCOG); 2006 Oct. 14p. (Green-top guideline; no. 24).
Stavroulis AI, Saridogan E, Creighton SM, Cutner AS. Laparoscopic treatment of endometriosis in teenagers. Eur J Obstet Gynecol Reprod Biol 2006;125:248–50.
The ESHRE Guideline for the Diagnosis and Treatment of Endometriosis. http://guidelines endometriosis org/ 2008. [disponivel em 25 de fev de 2010]8 – Revised American Society for Reproductive Medicine classification of endometriosis: 1996. Fertil Steril. 1997;67(5):817-21.
The Practice Committee of the American Society for Reproductive Medicine. Endometriosis and infertility. Fertil Steril. 2006;86(Suppl 4):S156-60.
Endometriose ovariana é um tipo de endometriose que se apresenta como endometriomas, ou seja, cistos no ovário com conteúdo líquido achocolatado, que variam de tamanho, podendo atingir grandes volumes. Acometem 17% a 44% das pacientes com endometriose. Em cerca de 98,9% dos casos apresentam outro foco de endometriose, estando normalmente associados a aderências ao peritônio posterior e uma chance aumentada de endometriose intestinal. Podem ser bilaterais, mas, ocorrem mais frequentemente no ovário esquerdo.
Não há um consenso sobre a origem da formação do endometrioma, podendo ser devido a uma invaginação do foco endometriótico da superfície para o parênquima ovariano ou ao sangramento de um foco dentro de um cisto ovariano prévio ou do parênquima ovariano.
Muitos casos são assintomáticos e a descoberta é um achado em exames de imagem. Em muitos casos estão associados a quadro clínico de dor, dispareunia (dor durante a relação sexual) e infertilidade.
O diagnóstico faz-se por exames de imagem como ultrassom transvaginal com preparo intestinal e ressonancia nuclear magnética da pelve.
Em relação ao tratamento, a endometriose ovariana não responde ao tratamento clínico, como com o uso de medicamentos que suspendam a menstruação. Outra opção de tratamento que deve ser evitada é a aspiração do cisto guiada por ultrassonografia, o que não é considerado uma boa alternativa devido aos altos índices de recorrência e ao risco de infecção, além de não permitir a retirada de tecido para estudo histopatológico.
O tratamento cirúrgico dos endometriomas é a alternativa terapêutica mais aceita e adequada de acordo com o pensamento atual. Entre as opções cirúrgicas, ooforectomia (retirada dos ovários) deve sempre ser evitada em pacientes em idade reprodutiva. Em relação a cirurgias conservadoras, existem duas opções: drenagem e cauterização da cápsula do cisto ou excisão completa do endometrioma com ooforoplastia. Numa revisão da biblioteca Cochrane essas duas modalidades de cirurgia conservadora foram comparadas e os resultados mostraram que a retirada cirúrgica da parede dos endometriomas apresenta menores taxas de recorrência dos sintomas como dor, dispareunia e dismenorréia; menor taxa de necessidade de nova cirurgia; além de menor taxa de recorrência do endometrioma. Para as pacientes que tentaram engravidar após o procedimento, as taxas de gravidez espontânea foram maiores no grupo de mulheres inférteis onde realizou-se a excisão da parede do cisto
Entretanto, por ser um tratamento invasivo, a grande discussão que surge é: Quando devemos tratar o endometrioma?
As indicações primárias para o tratamento dos endometriomas ovarianos são os sintomas de dor, a infertilidade e possibilidade de interferir com os tratamentos de infertilidade. Estudos têm mostrado o alívio dos sintomas de dor após o tratamento cirúrgico do endometrioma, com baixas taxas de recidivas. Em relação à infertilidade, estudos demonstram que a excisão de endometriomas pode aumentar a taxa de gestação em 50% após o procedimento.
Outra indicação de retirada dos endometriomas é a suspeita de malignidade. Sabe-se que um cisto diagnosticado por ultrassom como endometrioma tem uma chance menor de 1% de ser um cisto maligno, mas a possibilidade existe, portanto, um cisto persistente e grande (maior que 4 cm), em crescimento ou cujas características vem mudando e tornando-se mais suspeitas de malignidade, devem ser retirados.
No contexto de infertilidade, também normalmente utiliza-se o critério de tamanho (> 4 cm) para se indicar a cirurgia, mas ainda não há consenso. Endometriomas grandes podem prejudicar o tratamento de reprodução assistida, mas por outro lado a cirurgia para retirada do endometrioma leva a uma perda de tecido ovariano, diminuindo sua reserva ovariana, ou seja, número de óvulos disponíveis. Assim, o manejo do endometrioma em pacientes que serão submetidas a reprodução assistida deve ser particularizado levando em conta: sintomas, tamanho e localizações (se atrapalham ou impedem a captação de oócitos para fertilização in vitro, por exemplo).
A via de abordagem cirúrgica pode ser laparotomia (corte usual no abdome) ou laparoscopia (cirurgia por vídeo). Normalmente opta-se pela cirurgia videolaparoscópica por ter melhor recuperação pós operatória, menos dor e ser esteticamente favorável (incisão menor). Além disso, temos uma visão ampliada pela câmera, facilitando a visualização de outros possíveis focos de endometriose. Entreatanto a cirurgia por vídeo necessita de uma maior experiência do cirurgião. A curva de aprendizado é maior e em mãos inexperientes, pode acabar deixando doença, o que diminuiu o sucesso do tratamento e aumenta a recidiva; ou, por outro lado, levar a uma perda considerável de tecido ovariano normal, o que pode ser muito deletério nos resultados reprodutivos.
Recentemente, avanços vem surgindo nesta modalidade de cirurgia, com introdução de materiais cada vez mais precisos e com melhores imagens, tornando a cirurgia cada vez mais efetiva e segura. Uma novidade que vem sendo introduzida nas cirrugias de endometriose é auxílio da robótica. A cirurgia robótica apresenta algumas vantagens em relação a laparoscopia convencional, entre elas:
Com tudo isso, hoje é possível tratar a doença de forma satisfatória interferirindo o mínimo possível e preservando ao máximo o órgão e, principalmente, a reserva ovariana. Este esforço para preservação da integridade reprodutiva de nossas pacientes é nosso “ponto de honra”.
Referências Bibliográficas
É caracterizada pelo comprometimento mais profundo dos tecidos (acima de 0,5 cm), podendo involver intestinos, bexiga, ureteres e septo reto-vaginal (espaço entre reto, o útero e a vagina). A endometriose infiltrativa é a que mais causa dor e interferência no funcionamento dos órgãos. Com isso, sua evolução pode ser até comparada com a de um câncer – com a diferença de não levar à morte. É a que apresenta sintomatologia mais agressiva comprometendo o bem-estar e a qualidade de vida das pacientes, além de interferir na fertilidade mesmo quando são usadas as técnicas de Reprodução Assistida.
O diagnóstico da endometriose infiltrativa e profunda deve ser suspeitado inicialmente pela queixa clínica. A dispareunia (dor durante a relação) está fortemente associada a endometriose profunda. Além dos sintomas clássicos de endometriose, o quadro clínico dependerá do órgão acometido. O sintomas mais comuns são:
– Sintomas intestinais: algumas pacientes com acometimento intestinal podem apresentar, durante o período menstrual, disquesia, (dor na região pélvica ou lombo-sacral associada ao ato de defecação), sensação de inchaço ou distensão abdominal difusa, diarréia ou tenesmo (dor anal associada a dificuldade de evacuar).
-Sintomas urinários: quando a endometriose acomete a bexiga, podem surgir durante a menstruação, sintomas urinários como disúria (desconforto no ato da micção, com ou sem irradiação) e hematúria (sangue na urina).
Na endometriose infiltrativa os exames de imagens são fundamentais, tanto para auxílio diagnóstico como planejamento do tratamento. Entre eles, é essencial um ultrassom endovaginal realizado por um profissional especializado e precedido de um preparo intestinal (que esvazia o intestino, elimina as fezes, ajudando assim a visualizar as imagens). Recomenda-se ainda a Ressonância Magnética Pélvica. Dependendo da suspeita, outros exames de imagem devem ser pedidos como avaliação de vias urinárias, cistoscopia e a ecocolonoscopia.
Assim como a ovariana, a endometriose infiltrativa não responde ao tratamento clínico com a ajuda de medicamentos que suspendam a menstruação. A indicação de tratamento para estes casos é cirurgia, que deve ser realizada se a paciente apresentar sintomatologia.
Quanto à melhor abordagem cirúrgica, muitos serviços a realizam por laparotomia (cirurgia com corte usual do abdome, como na cesariana). Entretanto, o preconizado atualmente é a abordagem minimamente invasiva através da videolaparoscopia ou , mais atualmente, com auxílio da cirurgia robótica.
As vantagens da cirurgia videolaparoscópica quando comparada a laparotomia incluem: diminuição da permanência hospitalar, retorno mais rápido das pacientes às atividades do dia-a-dia (por exemplo, menos tempo longe trabalho), diminuição da morbidade (menor dor pós-operatória e com menos probabilidade de aderências e infecções da parede abdominal), diminuição da mortalidade e maior taxa de gravidez. A videolaparoscopia é preferível ainda à laparotomia porque proporciona a visualização de todo o abdômen e pelve com visão ampliada.
É muito importante ressaltar que cirurgia da endometriose infiltrativa é extremamente complexa e exige médicos qualificados e experientes neste tipo de intervenção. O planejamento da cirurgia é muito importante para que a paciente saiba com antecedência as possíveis implicações, como a possibilidade de ressecção de uma parte do intestino (retossigmoidectomia) ou da bexiga, caso haja um comprometimento destes órgãos, além de eventuais complicações. Tanto a paciente como a equipe devem estar prontos para todas as possibilidades.
Referências Bibliográficas
Abrao MS, Goncalves MO, Dias JA Jr, Podgaec S, Chamie LP, Blasbalg R.Comparison betweenclinical examination, transvaginal sonography and magnetic resonance imaging for the diagnosis of deep endometriosis.Hum Reprod. 2007;22:3092-3097.
Bazot M, Darai E, Hourani R, Thomassin I, Cortez A, Uzan S, Buy JN. Deep pelvic endometriosis: MR imaging for diagnosis and prediction of extension of disease. Radiology. 2004;232:379-389.
Chapron C, Dubuisson JB, Pansini V, Vieira M, Fauconnier A, Dousset B. Routine clinical examination is not sufficient for the diagnosis and establishing the location of deeply infiltrating endometriosis. J Am Assoc Gynecol Laparosc. 2002;9:115-119.
Degueldre M, Vandromme J, Huong PT, Cadiere GB. Robotically assisted laparoscopic microsurgical tubal reanastomosis: a feasibility study. Fertil Steril 2000;74:1020–3
Garry R, Clayton R, Hawe J. The effect of endometriosis and its radical laparoscopic excision on quality of life indicators. BJOG. 2000;107(1):44-54.
Goldberg JM, Falcone T. Laparoscopic microsurgical tubal anastomosis with and without robotic assistance. Hum Reprod 2003;18:145–7.
Moore J, Copley S, Morris J, Lindsell D, Golding S, Kennedy S. A systematic review of the accuracy of ultrasound in the diagnosis of endometriosis. Ultrasound Obstet Gynecol. 2002;20(6):630-4.
Redwine DB, Sharpe DR. Laparoscopic segmental resection of the sigmoid colon for endometriosis. J Laparoendosc Surg. 1991;1(4):217-20.
A endometriose pélvica é a condição patológica mais comum na pelve de adolescentes com dor pélvica crônica. Considerando que o diagnóstico definitivo de endometriose é feito por cirurgia, é difícil estabelecer a prevalência exata da doença em adolescentes. Estima-se que 4 a 17% das adolescentes que menstruam possuem endometriose.
Nas adolescentes com dor pélvica que não melhoraram com tratamento com anti-inflamatórios e anticoncepcionais e foram submetidas a videolaparoscopia, é descrita uma taxa de endometriose de 20 a 70%. As adolescentes com anormalidades do trato genital também têm maior risco para o seu desenvolvimento e podem desenvolver precocemente graus mais severos da doença.
O diagnóstico de endometriose deve ser suspeitado em adolescentes com dor pélvica, principalmente com história familiar da doença. O padrão da dor pode variar, assim como a intensidade, independente da severidade da endometriose. . Ao contrário da dismenorréia funcional (cólicas intensas sem estar associada a patologia), a dor associada à endometriose tende a aumentar ao longo do tempo e pode ocorrer por todo o mês.
O exame físico deve ser o mais completo possível, com investigação de possíveis anomalias congênitas, o que pode ser dificultado por muitas não serem ainda sexualmente ativas. A avaliação ultrassonográfica é frequentemente utilizada no diagnóstico, embora os endometriomas sejam raramente visualizados em adolescentes e normalmente a ultrassonografia não tenha boa acurácia para lesões superficiais da doença.
Em um estudo (Reese et al, 1996), foi encontrado endometriose estádio I em 79% das adolescentes com a doença e o estádio II foi encontrado em 12,3% . Em outro estudo, Propst e Laufer (1999) demonstraram que 77,4% das adolescentes tinham endometriose no estádio I e 22,6% no estádio II. Já pacientes com anomalias mullerianas obstrutivas têm maior probabilidade de se apresentarem nos estádios III e IV da doença. Assim, o ultrassom em adolescentes não é bom para diagnóstico de endometriose em adolescentes, mas serve para diagnóstico diferencial e descartar malformações congênitas.
O diagnóstico definitivo da endometriose é determinado pela videolaparoscopia, com estudo anatomopatológico das lesões biopsiadas. Mesmo sem a videolaparoscopia, a propedêutica atual, quando bem realizada, favorece o diagnóstico. Nesses casos, para se evitar que a adolescente seja submetida a uma cirurgia, pode-se instituir o tratamento empírico com anticoncepcionais orais de uso contínuo e anti-inflamatórios não hormonais.
O tratamento ideal para adolescentes e mulheres com endometriose ainda é discutível. O manejo da dor é o principal objetivo, uma vez que podem interferir nas atividades escolares e sociais da paciente de forma significativa.
O segundo objetivo é a manutenção da fertilidade. Há a preocupação de que a demora no diagnóstico e tratamento leve a doença a progredir e causar infertilidade no futuro. Acredita-se que o tratamento cirúrgico da endometriose no seu estádio inicial pode aumentar as chances futuras de gravidez. Assim, a demora no seu diagnóstico pode comprometer o perfil reprodutivo e a presença da dor intensa por período prolongado altera a qualidade de vida podendo levar a ansiedade e depressão.
Na prática, geralmente tenta-se prolongar o tratamento medicamentoso(anticoncepcionais orais e anti-inflamatórios, para posteriormente, se necessário, realizar a cirurgia com exérese das lesões de endometriose.
Quando ingeridos continuadamente, os anticoncepcionais podem decidualizar os implantes de endométrio (induzir alterações no tecido endometrial pelo efeito da progesterona) e causar remissão dos sintomas. Quando a dismenorréia é severa, seu o uso contínuo ao induzir amenorréia (ausência de menstruação), também pode aliviar os sintomas. Este tratamento é somente supressivo e não curativo. Foi relatado que este regime alivia a dor associada à endometriose em 80% das mulheres, embora o alívio possa ser transitório. Na ausência de melhora com tratamento clínico, a videolaparoscopia deve ser indicada,
Como a endometriose pélvica é uma doença crônica e progressiva e o tratamento definitivo não está estabelecido., as adolescentes com diagnóstico de endometriose deverão realizar seguimento por toda vida reprodutiva.
Paralelamente, como adjuvante pode-se oferecer um seguimento multiprofissional para tratamento da dor: terapia cognitivo-comportamental, biofeedback, antidepressivos, estimulação elétrica transcutânea (TENS) e acupuntura. Além disso, orientação sobre os aspectos nutricionais também é importante (vide dieta x endometriose).
Assim, as adolescentes necessitam de uma atenção especial, por necessidades específicas desta faixa etária. A frequente demora para o diagnóstico pode gerar ansiedade, sofrimento e danos psicológicos, além de poder comprometer a fertilidade futura. O diagnóstico e o tratamento precoce, a mudança no estilo de vida, a orientação nutricional, atividade física regular e seguimento adequado, podem minimizar os danos e melhorar a qualidade de vida.
Referências Bibligráficas
Em algumas vezes, os cirurgiões optam por, após o tratamento da endometriose, realizar uma nova videolaparoscopia para avaliar a eficácia do mesmo. Esse é o chamado second look.
Há outras indicações também onde uma nova videolaparoscopia pode ser adotada, como no caso de necessidade de eliminar sequelas do tratamento que causam dor e incômodo.
Sim. Com indicação de tratamento adequado, é possível curar a maioria das pacientes. E nos casos em que a doença não é eliminada por completo, conseguimos controlar a endometriose por meio de políticas de saúde e a sua recidiva (possível retorno).
Não. Embora seja um procedimento cirúrgico, quando bem indicada e realizada por uma equipe bem treinada, podemos dizer que o risco de complicações graves é perto de zero.
Vale ressaltar que somos uma equipe com vasta experiência laparoscópica, realizando em média de 600 a 800 procedimentos por ano.
Por isso, na ocorrência de complicações graves, possuímos capacidade e treinamento para identificar e tomar as atitudes necessárias para reverter o quadro.
Somos uma equipe que acredita e trabalha para que seja possível tratar a endometriose, preservando a fertilidade.
Para isso, utilizamos sempre técnicas extremamente modernas e seguras, minimamente invasivas e com alta efetividade.